تازه های بیوتکنولوژی
جدیدترین دستاوردهای بیوتکنولوژی، نانوبیوتکنولوژی و بیوانفورماتیک
تازه های بیوتکنولوژی
جدیدترین دستاوردهای بیوتکنولوژی، نانوبیوتکنولوژی و بیوانفورماتیککروماتین، کروموزوم ها و بسته بندی DNA
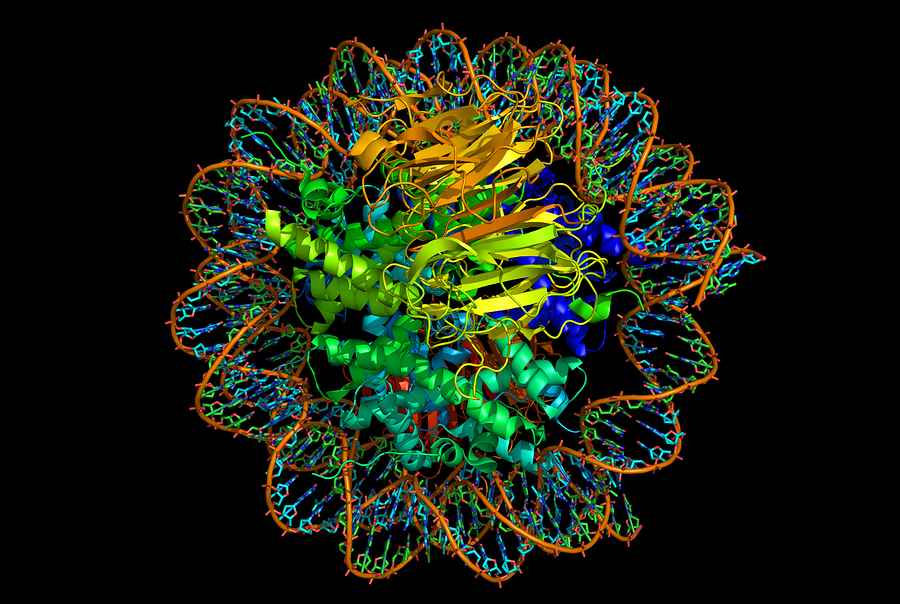
در هنگامی که یاختهها در حال تقسیم شدن نیستند، کروموزومهای آنها به صورت رشتههای نازک و نامنظمی در هسته دیده میشود که به آن کروماتین گفته میشود. واژه کروموزم به مفهوم جسم رنگی ، که در سال 1888 بوسیله والدیر بکار گرفته شد. هم اکنون این واژه برای نامیدن رشتههای رنگپذیر و قابل مشاهده با میکروسکوپهای نوری بکار میرود که از همانندسازی و نیز بهم پیچیدگی و تابیدگی هر رشته کروماتین اینترفازی در سلولهای یوکاریوتی تا رسیدن به ضخامت 1000 تا 1400 نانومتر ایجاد میشود. در پروکاریوتها نیز ماده ژنتیکی اغلب به حالت یک کروموزوم متراکم میشود. در برخی باکتریها علاوه بر کروموزوم اصلی که اغلب ژنها را شامل میشود کروموزوم کوچک دیگری که بطور معمول آن را پلاسمید مینامند، قابل تشخیص است گر چه تعداد کمی از ژنها بر روی پلاسمید قرار دارند.
اما
از آنجا که در بیشتر موارد ژنهای مقاومت به آنتی بیوتیکها بر روی آن
جایگزین شدهاند، از نظر پایداری و بقای نسل باکتری اهمیت زیادی دارد.
کروماتین در ساختمان کروموزوم به شکل لوپ دیده میشود. لوپها توسط
پروتئینهای اتصالی به DNA که مناطق خاصی از DNA را تشخیص میدهند پابرجا
میماند. سپس مراحل پیچ خوردگی نهایتا نوارهایی را که در کروموزومهای
متافازی دیده میشود ایجاد میکند. هر تیپ کروموزومی یک نوع نواربندی
اختصاصی را در ارتباط با نوع رنگ آمیزی نشان میدهد. این رنگ آمیزیها منجر
به مشخص شدن تعداد و خصوصیات کروموزومهای هر گونه از موجودات زنده میگردد.
که این خصوصیات تعدادی و مورفولوژیک کروموزومها را کاریوتیپ مینامند.
مراحل
تبدیل رشته کروماتین به کروموزوم برای تبدیل یک رشته کروماتینی 10 تا 30
نانومتری به یک کروموزوم ، علاوه بر لزوم همانندسازی رشته کروماتین سطوح
سازمان یافتگیای را در نظر میگیرند که ضمن آن با دخالت H3 ، H1 و
پروتئینهای غیر هیستونی پیچیدگیها و تابیدگیهای رشته کروماتین افزایش
مییابد، طول آن کم ، ضخامت و تراکمش زیاد میشود و به کروموزوم تبدیل
میگردد. این سطوح سازمان یافتگی و اغلب به صورت رسیدن از رشته 10 تا 30
نانومتری به رشته 90 تا 100 نانومتری تشکیل رشته 30 تا 400 نانومتری و در
مراحل بعد با افزایش پیچیدگیها و تابیدگیها ، ایجاد رشته 700 نانومتری و
بالاخره تشکیل کروموزوم دارای دو کروماتید و با ضخامت تا 1400 نانومتر در
نظر میگیرند.
اولین مرحله پیچیدگی و تراکم رشته کروماتین برای تبدیل به
کروموزوم با فسفریلاسیون شدید هیستونهای H3 ، H1 همراه است. پس از رها شدن
DNA از اکتامر هیستونی ، با دخالت آنزیمهای مسئول همانندسازی ، پیوندهای
هیدروژنی بین دو زنجیره گسسته میشود، هر زنجیره مکممل خود را میسازد و به
تدریج با ادامه همانندسازی ، دو مولکول DNA بوجود میآید که در هر مولکول
یک زنجیره قدیمی و زنجیره دیگر نوساخت است. بخشهای مختلف این دو مولکول DNA
که نظیر همدیگر هستند به تدریج که همانندسازیشان پایان میپذیرد، با
اکتامرهای هیستونی که نیمی از آنها اکتامرهای والدی و نیمی جدید هستند
ترکیب میشوند.
بعد از تشکیل ساختمان نوکلئوزومی ، دو رشته کروماتین 10
نانومتری و سپس رشتههای 30 نانومتری ایجاد میشوند. هر رشته کروماتین 30
نانومتر سطوح سازمان یافتگی را میگذارند، با مجموعهای از پروتئینهای غیر
هیستونی زمینهای یا اسکلتی آمیخته میشود و به یک کروماتید تبدیل میشود.
مجموعه دو کروماتید نظیر هم که از محل سانترومر بهم متصلاند کروموزوم
متافازی را ایجاد میکنند
کروماتین
از آن جایی که طول یک DNA صدها
هزار بار بیشتر از قطر یک سلول است، فشردگی DNA در یک سلول حائز اهمیت می
باشد. همچنین باید توجه داشت که یک مولکول طویل DNA در هنگام تقسیم سلولی
نباید گره بخورد. تعدادی از پروتئین ها به DNA متصل می شوند و با فشرده و
متراکم کردن آن کروموزوم های یوکاریوتی را بوجود میآورند. این پروتئین ها
بطور مرسوم به دو گروه عمده تقسیم می شوند: هیستونها و پروتئین های غیر
هیستونی. از ترکیب این پروتئین ها باDNA هستهای سلول یوکاریوت کروماتین
ایجاد می شود . هیستونها به مقادیر زیاد در سلولها وجود دارند (حدوداً 60
میلیون مولکول از هر نوع هیستون در سلول انسانی) و مقدار کلی آنها در
کروماتین حدوداً برابر مقدار DNA موجود درآن است.
طویل ترین مولکول DNA
در کروموزوم های انسانی، 108×8/2 جفت باز اندازه دارد و تقریباً 10 سانتی
متر میباشد. ساماندهی ساختاری کروماتین موجب شده است که مولکول DNA با این
اندازه بزرگ در یک هسته کوچک سلولی فشرده سازی شود و در آن، جای گیرد.
کروماتین به صورتی ساماندهی می شود که توالی های خاصی از DNA جهت فرآیندهای
سلولی مانند رونویسی، همانندسازی، تصحیح و نوترکیبی همیشه در دسترس قرار
داشته باشد.
هیستونها در اوّلین سطح پیچیدگی کروموزم که همان نوکلئوزوم
است شرکت دارند. نوکلئوزوم یک ترکیب DNA و پروتئین است که در سال 1974 کشف
شد. وقتی هسته های اینترفازی به آرامی شکسته می شوند و محتویات آنها در
غلظت فیزیولوژیک جدا سازی و با میکروسکوپ الکترونی مطالعه می گردند دیده می
شود که اکثر کروماتین ها به شکل رشته ای با قطر 30 نانومتر هستند . در
غلظت پایین نمک هایی مثل Mg2+ که پیچ خوردگی کروماتین باز می شود در زیر
میکروسکوپ الکترونی یک سری از رشته هایی که اصطلاحاً دانه های تسبیح (beads
on a string) نامیده می شوند مشاهده می گردند . رشته ای که دانه ها را به
هم وصل می کند از جنسDNA است و هر دانه یک نوکلئوزوم می باشد که شامل DNA
پیچیده شده به دور یک هسته پروتئینی است و 10 نانومتر قطر دارد. این هسته
پروتئینی از هیستونها ساخته شده است.
ساختار نوکلئوزوم اوّلین بار وقتی
شناسایی شد که آنها را بوسیله هضم آنزیمی از کروماتین جدا کردند. آنزیمی
بنام نوکلئاز با اثر بر روی کروماتین، DNA حد فاصل بین نوکلئوزوم ها را حذف
می کند. این DNA اصطلاحاً DNA رابط (Linker DNA) نامیده می شود. هر ذره
مرکزی نوکلئوزوم (Nucleosome Core Particle) شامل ترکیبی از هشت پروتئین
هیستونی (دو مولکول از هر کدام از هیستونهای H2A،H2B،H3 وH4 ) به اضافه
DNA دو رشته ای به طول 147 جفت باز است. اکتامر هیستونی یک هسته پروتئینی
بوجود میآورد که DNA دو رشته ای به دور آن می پیچد.
هر ذره مرکزی
نوکلئوزوم بوسیله یک DNA رابط که طول آن متفاوت است از ذره مرکزی نوکلئوزوم
بعدی جدا شده است. اندازه DNAی اتصال دهنده در گونه های مختلف، متفاوت
است. این تفاوت حتی در بین سلول های مختلف یک جاندار نیز دیده شده است که
در حدود 90-10 جفت باز را شامل می شود. اصطلاح نوکلئوزوم به ذره مرکزی
نوکلئوزوم و DNA رابط مجاور آن اطلاق می شود ولی گاهی اصطلاح نوکلئوزوم
بجای ذره مرکزی نوکلئوزوم نیز استفاده می شود. بطور میانگین در فواصل حدود
200 جفت نوکلئوتید یک نوکلئوزوم وجود دارد. مثلاً در یک سلول دیپلوئید
انسانی با 109×4/6 جفت نوکلئوتید تقریباً 30 میلیون نوکلئوزوم وجود دارد.
تشکیل نوکلئوزوم ها یک مولکول DNA را به رشته های کروماتین تبدیل می کند که
طول آن یک سوّم طول اوّلیه است. در هنگام همانند سازی سلول، بلافاصله بعد
از این که چنگال همانند سازی از منطقه مورد نظر عبور کرد، DNA مجدداً به
صورت نوکلئوزوم در خواهد آمد. این فرآیند توسط چاپرون های (chaperons) خاصی
انجام می گیرد که توانایی اتصال به هیستون ها و مونتاژ آنها را دارا می
باشند.
ساختار دقیق ذره مرکزی نوکلئوزوم
ساختار دقیق یک ذره مرکزی نوکلئوزوم در سال 1997 بیان شد. در واقع در یک ذره مرکزی نوکلئوزوم یک هسته هیستونی دیسک مانند وجود دارد که DNA تقریباً 75/1 دور بطور محکم به صورت چپ گرد به دور آن پیچیده است. هر چهار نوع هیستونی که هسته نوکلئوزوم را می سازند پروتئین هایی نسبتاً کوچک (102 تا 135 اسیدآمینه) و خیلی حفاظت شده (conserved) هستند. مثلاً سکانس اسید آمینه ای H3 در نخود و تیموس گاو فقط در 4 موقعیت از 102 موقعیت و در بافت خیار دریایی و تیموس گاو فقط در یک اسیدآمینه با هم تفاوت دارند؛ این نشان می دهد که همه اسیدهای آمینه هیستون در عملکرد آن نقش دارند. بطوریکه تغییر در یک اسیدآمینه برای سلول کشنده است. اکثریت جهش ها در هیستون های اصلی کشنده هستند و تعداد کمی هم که کشنده نیستند باعث تغییر در بیان طبیعی ژنها می شوند. البته انواع گوناگونی از هیستون های فرعی نیز کد می شوند که ژن های آنها نسبت به ژن های هیستون های اصلی در مناطق حفاظت شده متفاوت می باشند. این نوع از هیستون ها در بسیاری از جانداران خصوصاً مهره داران وجود دارند. به عنوان مثال، نوع ویژه ای از H2A به نام H2AX وجود دارد که در بعضی از مناطق نوکلئوزومی به چشم میخورد. در مناطقی که DNA ی دو رشته ای می شکند، H2AXفسفوریله می شود ودر فرآیند اصلاح کروموزوم شرکت می کند. این عمل احتمالاً در اثر وجود مناطق اتصالی برای پروتئین هایی است که نقش اصلاح را به عهده دارند. نوکلئوزوم های H3 در مناطق سانترومری توسط هیستون دیگری به نام CENP-A جایگزین شده است که نقش آن در اتصال به میکروتوبول های دوک تقسیم در هنگام میتوز می باشد. تعداد زیادی از این نوع هیستون های فرعی، تفاوت اندکی در توالی هایشان نسبت به هیستون های اصلی دارند.
همه هیستون ها یک موتیف ساختاری بنام تاخوردگی هیستونی یاHiston Fold (HF) دارند که از سه مارپیچ آلفا تشکیل شده که بوسیله دو لوپ بهم وصل شده اند . در زمان تشکیل نوکلئوزوم،HF ها ابتدا بهم وصل می شوند و دایمرهای H3-H4 و H2B–H2A بوجود می آید. دایمرهای H3- H4 ، تترامر می شوند. درنهایت تترامر H3- H4 به دو دایمر H2B–2A متصل می گردد و اکتامر هیستونی بوجود می آید که DNA به دور آن میپیچد.

ارتباط بین DNA و هیستون بسیار زیاد است. 142 پیوند هیدروژنی بین DNA و هسته هیستونی در هر نوکلئوزوم وجود دارد. تقریباً نیمی از این اتصالات بین اسکلت زنجیره اسیدآمینه ای هیستونها و اسکلت فسفودیاستر DNA برقرار می شود. تعداد زیادی برهم کنش های هیدروفوب و پیوندهای یونی نیز DNA و پروتئین را در نوکلئوزوم ها بهم متصل می کنند. تقریباً بیش از یک پنجم اسیدهای آمینه در هر هسته هیستونی لیزین یا آرژنین (زنجیره جانبی بازی دارند) هستند و بار مثبت آنها با بار منفی DNA بر هم کنش می کند. این تعداد زیاد بر هم کنش غیر اختصاصی نشان می دهد که DNA با هر توالی می تواند به اکتامر هیستونی متصل شود. مسیری که DNA به دور هیستون می پیچد صاف و هموار نیست و DNA چندین خمیدگی دارد چون سطح هسته هیستونی نیز صاف و هموار نیست.
تنظیم فشردگی و عملکرد کروماتین توسط تغییر در دم های هیستونی علاوه
برHF ها انتهای N- ترمینال هر یک از پروتئین های هیستونی موجود در هسته
نوکلئوزومی از نوکلئوزوم به سمت بیرون گسترش یافته است و شامل های 19 تا 39
اسید آمینه می باشد. انتهای C- ترمینال پروتئین های H2A و H2B نیز دارای
های 8 اسید آمینه است. به این نواحی انتهایی، اصطلاحاً دم های هیستونی گفته
می شود که از نوکلئوزوم به سمت بیرون گسترش یافته و در شکل A5 نشان داده
شده است. این دم های هیستونی در معرض چندین نوع مختلف از تغییرات کووالنت
هستند که برروی ساختار و عملکرد کروماتین تاثیر گذار است. دمهای هیستونی
جهت فشردگی کروماتین و ایجاد رشته های 30 نانومتری ضروری می باشند. به
عنوان مثال، تجربیات اخیر نشان می دهد که دم های N- ترمینال هیستون H4
خصوصاً لیزین 16 اُم برای تشکیل ساختارهای 30 نانومتری اهمیت دارد. در رشته
30 نانومتری این لیزین که دارای بار مثبت است با محل اتصال H2A - H2B در
سطح نوکلئوزوم بعدی (که دارای بار منفی می باشد) واکنش می دهد.
دم های
هیستونی می توانند دچار تغییرات پس از ترجمه ای مانند استیلاسیون،
متیلاسیون، فسفوریلاسیون و اوبیکوئیتینه شدن، شوند. در شکل B5 انواع مختلفی
از تغییرات پس از ترجمه هیستون ها در انسان را مشاهده می کنید. یک پروتئین
هیستونی هیچگاه به طور همزمان تمامی این تغییرات را نمی تواند داشته باشد
اما هیستون های موجود در یک نوکلئوزوم ممکن است مجموعاً چندین نوع از این
تغییرات را دارا باشند. به انواع مختلف تغییرات پس از ترجمه که در مناطق
مختلفی از کروماتین به وجود می آید اصطلاحاً یک کد هیستونی گویند. این
تغییرات با ایجاد یا حذف سایت های اتصالی برای پروتئین های متصل شونده به
کروماتین، بر عملکرد کروماتین تاثیر می گذارند.
استیلاسیون هیستون
لیزین
های دم های –N ترمینال هیستونی می توانند توسط آنزیم های ویژه ای دچار
استیلاسیون و دِاستیلاسیون برگشت پذیر شوند. در فرم استیله شده، بار مثبت
گروه آمینی ε لیزین خنثی می شود. همان طور که در قسمت های قبل گفته شد،
لیزین 16 اُم در هیستون H4 جهت تا خوردگی رشته های 30 نانومتری ضروری است
زیرا با بار منفی در سطح نوکلئوزوم مجاور واکنش می دهد. درنتیجه هنگامی که
لیزین 16 اُم H4 استیله می شود، فشردگی کروماتین کاهش می یابد تا رونویسی و
همانندسازی بهتر انجام گیرد.
استیلاسیون هیستون در مناطق دیگری از H4 و
همچنین سایر هیستون ها بدلیل این که باعث کاهش فشردگی کروماتین می شود
موجب افزایش حساسیت DNAی کروماتین در برابر نوکلئازها می گردد . این پدیده
را می توان با هضم نمودن DNAی جدا شده از سلول به وسیله ی آنزیم DNase I
نشان داد. بعنوان مثال در سلول های غیر اریتروئید ژن بتاگلوبین از نظر
رونویسی غیر فعال است. در این سلول ها، هیستون های ژن فوق نسبتاً غیر
استیله می باشند و لذا بدلیل فشردگی کروماتین، DNA مقاومت بیشتری نسبت به
DNase I دارد. ولی در سلولهای پیش ساز اریتروئید که ژن بتاگلوبین در آن ها
رونویسی می شود، این هیستون ها استیله شده اند و بدلیل عدم فشردگی کروماتین
DNA در برابر DNase I حساس میباشد. این نتایج نشان می دهند که ساختار
کروماتینی DNAی غیر رونویسی شونده بسیار فشرده می باشد و بنابراین از هضم
شدن در برابر آنزیم DNase I محافظت می شود. در این مناطق RNA پلی مراز و
سایر پروتئین های مورد نیاز برای رونویسی نمیتوانند به این DNA ی فشرده
متصل شوند. اما در DNA ای که رونویسی می گردد، عکس این عمل رخ می دهد. در
کروماتین فشرده به دلیل چسبیدن هیستون ها و سایر پروتئین ها آنزیم DNase I
نمی تواند عمل نماید. در مقابل، DNA ای که به طور فعال رونویسی می شود نسبت
به هضم شدن در برابر DNase I بسیار حساس می باشد.
مطالعاتی که بر روی
مخمرها انجام شده است نشان می دهد که استیلازهای هیستونی (Histone
Acetylases یا HATs) جهت فعال سازی کامل رونویسی تعدادی از ژن ها ضروری
است. در نتیجه، تصور می شود کنترل استیلاسیون N – ترمینال هیستون ها در
مناطق خاص کروموزومی، در کنترل بیان ژن ها نقش داشته باشد.
سایر تغییرات هیستونی
همان
طور که در شکل B5 نشان داده شده است، دم های هیستونی در کروماتین می
توانند دچار تغییرات گوناگونی شوند. گروه های آمینوی ε لیزین می توانند
متیله شوند. متیله شدن فرآیندی است که از استیله شدن جلوگیری می نماید
بنابراین موجب حفظ بار مثبت خواهد شد. علاوه براین، گروه های آمینوی ε
لیزین می توانند یک، دو یا سه مرتبه متیله شوند. زنجیره های جانبی آرژنین
نیز می توانند دچار متیلاسیون شوند. زنجیره های جانبی سرین و ترئونین می
تواند به صورت برگشت پذیری فسفوریله شوند و در نتیجه ایجاد بار منفی
نمایند. همچنین یک مولکول یوبی کوئیتین که دارای 76 اسید آمینه می باشد می
تواند به صورت برگشت پذیری به لیزین دم C – ترمینال درH2A و H2B متصل شود.
به خاطر بیاورید که اضافه شدن چندین مولکول یوبی کوئیتین به یک پروتئین،
می تواند پروتئین مزبور را جهت تجزیه شدن در پروتئازوم نشاندار نماید با
این وجود در این مورد خاص، اضافه شدن یک مولکول یوبی کوئیتین بر پایداری
هیستون و ساختار کروماتین اثری ندارد.
همان طور که قبلاً هم گفته شد،
انواع مختلفی از تغییرات اسیدآمینه ای در دم های هیستونی به کنترل تراکم
کروماتین و همچنین توانایی آن در رونویسی، همانندسازی و اصلاح کمک می
نماید. این موضوع را می توان با مقایسه ی تغییرات خاص در کروماتین فشرده
(هتروکروماتین) و کروماتین کمتر فشرده (یوکروماتین) نشان داد .
ساختار پویای نوکلئوزوم ها
سالهای
متمادی بیولوژیستها فکر می کردند که وقتی نوکلئوزوم در یک مکان DNA تشکیل
می شود همانجا ثابت می شود چون ارتباط محکمی بین DNA و هسته هیستونی آن
وجود دارد. اگر این درست باشد بعضی مکانیسم های DNA که نیاز به خواندن DNA
دارند دچار مشکل می شوند. از جمله مکانیسم هایی که نیاز به دسترسی سریع به
بعضی توالیهای DNA دارند میتوان به فرآیندهای رونویسی و همانند سازی DNA
اشاره کرد. آزمایشات نشان می دهد که DNA نوکلئوزوم 4 بار در ثانیه در هر
قسمت باز می شود. قسمت باز شده 10 تا 50 میلی ثانیه قبل از اینکه دوباره
بسته شود، آزاد باقی می ماند. بنابراین مهلت برای اتصال پروتئین ها وجود
دارد .
چون سلولهای یوکاریوت دارای تعداد گوناگونی از کمپلکس های تغییر
وضع دهنده کروماتین وابسته به ATP (ATP- depemdemt chromatih remodeling
complexe) هستند، شل شدن اتصال هیستون – DNA در کروماتین موجود در سلول
صورت میگیرد. ساب یونیتی که دراین کمپلکس ها ATP را هیدرولیز می کند از
نظر تکاملی مرتبط با خانواده هلیکازهای DNA می باشد و به پروتئین های
نوکلئوزوم و همچنین به DNA که به دور آن پیچیده شده است باند می شود. با
استفاده از انرژی هیدرولیز ATP این زیرواحد DNA را نسبت به هسته پروتئینی
حرکت می دهد و ساختار نوکلئوزوم را بصورت موقت تغییر می دهد و باعث می شود
که اتصال DNA و پروتئین شل شود. در سیکل های تکراری هیدرولیز ATP کمپلکس
های تغییر وضع دهنده باعث سُرخوردن نوکلئوزوم (Nucleosome Sliding) و کشیدن
هسته نوکلئوزوم در طول DNA دو رشته می شوند و باعث میگردند که DNA
نوکلئوزومی در معرض پروتئین های سلولی قرار گیرد. بعلاوه بوسیله همکاری با
پروتئین های دارای بار منفی که بعنوان چاپرونهای هیستونی عمل می کنند بعضی
ازکمپلکس های تغییر وضع دهنده قادر هستند که کل یا قسمتی از هسته هیستونی
را از نوکلئوزوم آزاد کنند (یا اکتامر هیستونی را بطور کامل از DNA جدا می
نمایند یا باعث تعویض هیستونهای H2B –H2A می شوند) .
سلولها حاوی چندین
نوع متفاوت از کمپلکس های تغییر وضع دهنده کروماتین هستند که برای مقاصد
مختلفی تخصص یافته اند. اکثر این کمپلکس ها مجموعه های پروتئینی بزرگی
هستند که شامل 10 یا مقدار بیشتری زیر واحد می باشند. فعالیت این کمپلکس ها
کاملاً بوسیله سلول کنترل می شود. زمانیکه ژنها روشن یا خاموش میشوند
کمپلکس های تغییر وضع دهنده به سمت منطقه خاصی از DNA که بایدعمل نمایند
حرکت می کنند و ساختار کروماتین را تحت تاثیر قرار می دهند.
همانطوری که
بحث شد نوکلئوزوم می تواند مکانهای مختلفی را روی DNA اشغال نماید. با این
حال وجود پروتئین های دیگری که به طرز محکمی به DNA متصل شده اند در
جایگیری نوکلئوزوم اثر مهمی دارند. بعضی پروتئین هایی که به DNA متصل شده
اند تشکیل نوکلئوزوم در کنار خود را تسهیل می کنند. بعضی پروتئین ها نیز
موانعی بوجود می آورند که نوکلئوزوم در بین آنها تشکیل شود. بنابراین مکان
دقیق نوکلئوزوم ها در طول رشته DNA عمدتاً وابسته به وجود و چگونگی پروتئین
های متصل شده به DNA است. بدلیل وجود کمپلکس های تغییروضع دهنده وابسته به
ATP آرایش نوکلئوزوم ها روی DNA بسیار پویا است و بر اساس نیاز سلول به
سرعت تغییر می کند.
بسته بندی نوکلئوزوم ها بصورت رشته کروماتین
DNA
موجود در یک سلول زنده یوکاریوت بندرت به شکل دانه تسبیح است. نوکلئوزوم
روی یکدیگر بصورت منظم بسته بندی می شوند و حالت متراکمی برای DNA ایجاد می
کنند. وقتی که هسته اینترفازی با ظرافت لیز شود و در غلظت فیزیولوژیک به
کمک میکروسکوپ الکترونی مشاهده گردد قسمت اعظم کروماتین به شکل رشته هایی
با ضخامت 30 نانومتر دیده می شود که نسبت به حالت دانه های تسبیح ضخیم تر
است.
نوکلئوزوم ها چگونه در رشته های کروماتین 30 نانومتری بسته بندی می
شوند ؟ این سئوال هنوز جواب واضح و مشخص نداشته است ولی اطلاعات مهمی در
خصوص ساختار آن بدست آمده است. مخصوصاً آنالیز ساختار با قدرت تفکیک بالا
روی رشته های نوکلئوزومی کوتاه و همولوگ انجام شده است. این رشته ها به کمک
هیستونها و مولکولهای DNA تخلیص شده بوجود آمده اند. ساختار یک تترا
نوکلئوزوم که توسط کریستالوگرافی اشعه X بدست آمده است بر مدل زیگزاگی بسته
بندی نوکلئوزوم ها در ساختار 30 نانومتری دلالت دارد. ولی بررسی رشته های
نوکلئوزومی بزرگتر با میکروسکوپ کرایوالکترون از ساختار سلونوئیدی
نوکلئوزوم حمایت می نماید .
چه چیز باعث می شود که نوکلئوزوم ها بطور
محکم بصورت فیبرهای 30 نانومتری بسته بندی شوند ؟ اتصالات نوکلئوزوم به
نوکلئوزوم که بوسیله دم های هیستونی مخصوصاً دم H4 بوجود میآید عامل مهمی
برای ایجاد ساختار 30 نانومتری است. عامل مهم دیگر هیستون H1 است که
معمولاً نسبت یک به یک با نوکلئوزوم ها دارد. این هیستون از هر کدام از
هیستونهای هسته هیستونی بزرگتر است و در طول تکامل کمتر حفاظت شده است. یک
مولکول منفرد هیستون H1 به هر نوکلئوزوم متصل می شود و در این موقعیت هم
به DNA و هم به پروتئین اتصال دارد و مسیر DNA را طوری تغییر می دهد که
کروماتین 30 نانومتری شکل می گیرد. اگرچه بطور دقیق نمیدانیم چگونه H1
نوکلئوزوم ها را در کنار یکدیگر قرار میدهد تا رشته 30 نانومتری تشکیل شود
ولی بنظر می رسد که تغییر در مسیر DNA برای متراکم کردن DNA مهم است.
هیستون H1 اکثریت موجودات بهم مرتبط هستند ولی توالی اسیدآمینه آنها متفاوت
است.