تازه های بیوتکنولوژی
جدیدترین دستاوردهای بیوتکنولوژی، نانوبیوتکنولوژی و بیوانفورماتیک
تازه های بیوتکنولوژی
جدیدترین دستاوردهای بیوتکنولوژی، نانوبیوتکنولوژی و بیوانفورماتیکآپوپتوزیس
سلول های موجودات پر سلولی ،اعضاء یک جامعه با سازمان یافتگی بالا هستند.تعداد سلول های این جامعه نه تنها توسط تقسیم سلولی،بلکه بوسیله میرگ سلولی نیز کنترل می شود.اگر سلول ها کارایی لازم را نداشته باشند،با فعال کردن مرگ سلولی دست به خود کشی می زنند که به این فرایند مرگ برنامه ریزی سلول می گویند.
در سال 1972دانشمندی به نام کر برای اولین بار واژه آپوپتوز (یک کلمه یونانی است به معنای ریزش برگ )را برای توصیف مرگ فیزیولوژی سلول معرفی کرد. قطعاً مرگ سلولی در توسعه گیاهان و جانوران تقش مهمی را بازی می کند و معمولا در بلوغ هم ادامه دارد.روزانه میلیون ها سلول در بدن تولید و تعدادی هم از بین می رود.مرگ سلولی در واقع مانع از پرده دار شدن دست های ما و تطویل دم جنین ها و مانع از پاسخ سیستم ایمنی بدن به پروتئین های خودی می شود.میانکنش های مرگ سلولی به دو طریق تنظیم می شوند:
1-اغلب سلول ها در موجودات سلولی نیهز به پیام های دارند که زنده بمانند در غیاب این پیام ها (فاکتور های تروفیک)سلول برنامه خود کشی را فعال می کند.
2-در برخی از زمینه های تکوینی مانند سیستم ایمنی،پیام های ویژه پیام های مرگ را القا می کنند.سلول ها یا در عدم وجود پیام ها ی حیاتی می میرند یا توسط پیام های کشنده از سایر سلول ها کشته می شوند.
آپوپتوزیس یک فرایند فیزیولوژیکی حیاتی برای نمو فعال و طبیعی و همچنین حفظ هموستازی می باشد.زمانی که سلول تحت تاثیر عوامل مختلف محیطی و یا حتی درونی همانند اشعه های یونیزان،دارو های سیتوتوکسیک،هیپرترمی(از راه های درمان سرطان موضعی مثل سرطان پوست)هورمون های گلوکوکورتیکوئیدی و عوامل دیگر قرار می گیرند،محتویات آن از جمله DNAدستخوش تغییراتی می شود که در صورت ادامه حیات آن منجر به ناهنجاری های شدیدی از جمله سرطانی شدن سلول می شود.عوامل دیگری مثل باکتری های پاتوژن داخل سلولی نظیر سالمونلا،شیگلا،لیستریا،نیز در خلال عفونت زایی خود با تغییر در برخی مسیر های متابولیکی و بیوشیمیایی داخل سلولی می توانند در هدایت سلول به سمت این نوع خاص از مرگ دخیل باسند.اپوپتوزیس در شرایط طبیعی باعث حذف سلول های پیر ،آسیب دیده ،اضافی و مضر میشود و در تکامل و هموستاز بافتی ضروری است. در ترمیم و نو سازی بافتی و حذف سلول های Tنقش دارد.هر گونه اختلال در روند آپوپتوزیس منجر به بیماری می شود که می تواند ناشی از کاهش مرگ سلولی باشد که منجر به ایجاد و رشد سلول های سرطانی و یا اختلالات خود ایمنی می گردد.ازافزایش غیر طبیعی مرگ سلولی نیز در بیماری هایی مثل ایدز دیده میشود.
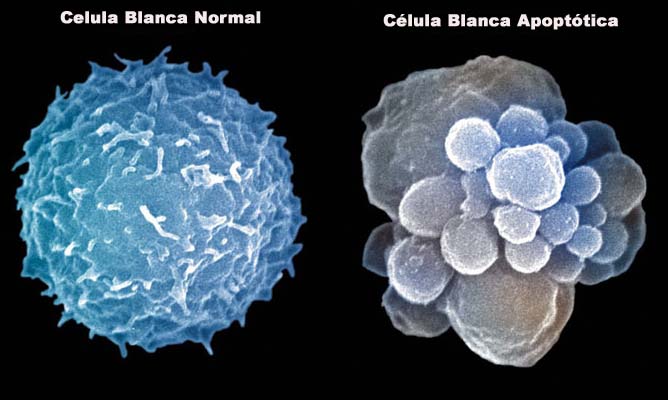
تغییرات مورفولوژیکی سلول طی آپوپتوزیس
سلول چروکیده شده ،محتویات آن متراکم شده و اسکلت سلولی از بین میرود،پوشش هسته از بین می رود و هسته تجزیه میشود.کروماتین های هسته ای متراکم شده و به قطعاتی تجزیه می شود. در نهایت اجسام آپوپتیک را به وجود می آید که با حمله ماکروفاژ ها از بین می رود.
بر خلاف آپوپتوزیس سلول هایی که در پاسخ به آسیب بافتی می میرند تغیرات مورفولوژیکی متفاوتی متفاوتی را نشان می دهند که به آن نکروزیس میگویند که این تغییرات شامل:
ï دیواره سلول متورم و بزرگ می شود
ï غشا تخریب شده و محتویات سلول به بیرون می ریزد
ï در نکروز واکنش های التهابی دیده می شود.
تفاوت های آپوپتوز و نکروز
- تغییرات مورفولوژیک
1-در آپوپتوزیس غشا بدون اینکه انسجام خود را از دست بدهد به صورت حفره حفره در می آید اما در نکروز غشا انسجام و یکپارچگی خود را از دست می دهد
2-شروع آپوپتوزیس با چروکیدگی سیتوپلاسم و تراکم هسته آغاز می گردد اما شروع نکروز با متورم شدن سیتو پلاسم و میتوکندری همراه است
3-خاتمه آپوپتوزیس باتشکیل حفرات غشایی به نام اجسام آپوپتوتیک همراه است اما نکروز بدون تشکیل این حفرات و تا لیز کامل سلول پیش می رود
در شکل این تغییرات نشان داده شده است
- تغییرات بیوشیمیایی
1- در نکروز تعادل یونی محیط در داخل و خارج سلول از بین میرود اما در آپوپتوزیس طی واکنش های آنزیمی فعال این تعادل حفظ است(هموستازیس)
2-نکروز به انرژی نیاز ندارد اما آپوپتوزیس با مصرف انرژی ATPو وابسته به واکنش های آنزیمی است
3-در نکروز DNAبه صورت تصادفی در جایگاه های غیر اختصاصی شکسته می شود اما در آپوپتوزیس این شکستگی ها تصادفی نیست و در فواصل بین نوکلئوزوم ها رخ می دهد.
-در آپوپتوزیس فاکتور هایی مثل سیتوکرومC،اندونوکلئازG،SMACوAIFاز میتو کندری به سیتوپلاسم آزاد می شود
5-ترکیب فسفولیپید های غشا طی آپوپتوزیس تغییر می کندمثلاًفسفاتیدیل سرین که در لایه سیتوزول غشا حضور دارد به لایه اگزوپلاسمیک می رود که این یک پیام برای ماکروفاژهاست تا سلول مورد نظر را فاگوسیتوز کنند.
- تغییرات فیزیولوژیک
1-سلول های آپوپتوتیک فاقد التهاب در بافت اند یا التهاب کمی دارند اما در نکروز سلول های مجاور تحت تاثیر قرار می گیرندو در بافت پاسخ التهابی ایجاد می کنند
2-آپوپتوزیس توسط محرک هایی مثل فقدان فاکتور رشد،تغییرات هورمونی و غیره القا می شوند اما نکروز توسط ویروس ها ،تغییرات دمایی ناگهانی ،کمبود اکسیژن و سموم متابولیکی در سلول پدید می آید.
کاسپازها
گروهی از پروتئاز های سیستئینی هستند که از عوامل اصلی آپوپتوزیس محسوب می شودو به صورت گروهی در اغلب سلول ها به فرم غیر فعال وجود دارند.این آنزیم ها در روندی به فرم فعال تبدیل می شوند القا اپوپتوزیس توسط رسپتور ها ی مرگ سلولی منجر به فعال شدن کاسپاز های آغاز گر مثل کاسپاز8و10 می شود و این کاسپاز ها منجر به فعال شدن کاسپازهای دیگری مثل 3یا6 وسایر کاسپاز ها می گردند.
ویژگی عمومی کاسپاز ها
1-پرتئازهای اختصاصی هستند.
2-منجر به تجزیه پروتئین بعد از ریشه آسپارتیت می شوند.
3-توالی 3 اسد آمینه قبل از آسپارتیت تعیین کنندهسوبسترای اختصاصی آنهاست.
4-عمل آنها تنظیم کننده مرگ سلولی است لذا به عنوان کلید های مرگ سلولی محسوب می شود.
5-کاسپاز ها در ساختمان خود دارای پرودمین های هستند که یک دمین اختصاصی برای اتصال پروتئین –پروتئین می باشند ونقش مهمی در فعال سازی کاسپاز ها دارد.
ماشین درون سلولی مسئول آپوپتوزیس در تمام سلول های جانوری مشابه است.
که این ماشین دارای اجزاء وابسته به خانواده ای از پرتئاز ها می باشد که دارای شرایط و ویژگی های منحصر به فردی هستند در جایگاه فعالشان اسید آمینه سیستئین دارند و پروتئین هدف خود را در جایگاه اختصاصی اسید آمینه آسپارتیک اسید می شکنند به همین خاطر به آنها کاسپاز گفته می شود
چگونگی فعال شدن کاسپاز ها
کاسپاز ها به صورت غیر فعال یا پروکاسپازسنتز می شوند ودر پاسخ به پیام های پیش آپوپتیک فعال می گردند که این فعال سازی معمولاً با ایجاد یک برش در اسید آمینه آسپارتیک اسید انجام می شود.
نحوه فعال شدن پروکاسپاز
هرپرو کاسپاز دارای سه دمین است :
پرودمین NH2 ،زیر واحد کوچک ((20KDو زیر واحد بزرگ(310KD)
طی آپوپتوزیس به خاطر شکستگی و جدا شدن پرودمین از زیر واحد های کوچک و بزرگ پروکاسپاز به کاسپاز فعال تبدیل میشود.در این هنگام کاسپاز فعال روی جایگاه های اختصاصی کاسپاز های دیگر اثر میگذارد و می توتند کاسپاز های پایین دست خود را فعال کند و سبب ایجاد یک آبشار پروتئولیتیکی می شود سپس عده دیگر کاسپاز های فعال شده ،دیگر پروتئین های کلیدی را در سلول می شکنند.
کاسپاز هایی که در راس قرار دارندبا تحریک واکنش اتو پروتئولیز با اتصال یک فعال کننده،فعال می شوند،سپس تعدای از آنها لامین های هسته ای را برش می دهند و به عنوان مثال سبب شکسته شدن غیر قابل برگشت لامین Aدر هسته می شوند که این باعث فرو پاشی پوشش هسته می شود.
عده دیگر از کاسپاز ها پروتئین هایی را می شکنند که آنزیم های تجزیه کننده DNAرا مهار می کنند با آزاد شدن این DNase ها ،DNAدر هسته سلول می شکند.
کاسپاز ها مبنای متفاوتی برای تقسیم بندی دارند که می توان انها را بر اساس ساختار ،ویژگی نسبت به سوبسترا،فعالیت فیزیولوژیک و اندازه پرودمین تقسیم بندی کرد اما چیزی که در اپوپتوزیس اهمیت دارد تقسیم بندی بر اساس پرودمین آنهاست که شامل:
1-کاسپاز های آغازگر که پرودمین طویلی دارندو شامل کاسپاز های 8،9،10،12
2- کاسپاز های اجرایی که پرودمین کوتاهی دارندو شامل کاسپاز های3،6،7
مسیر های آپوپتوزیس
دو مسیربرای انتقال سیگنال درون سلولی برای آپوپتوزیس شناسایی شده است:
1-مسیر خارجی یا مسیر رسپتور های مرگ سلولی
2-مسیر داخلی یا مسیر میتوکندریایی
مسیر خارجی Extrinsic pathway
در غشای پلاسمایی اغلب سلول ها گیرنده مرگ وجود داردشناخته ترین گیرنده های مرگ عبارتنداز:Fas/Apo1/CD95/وTNF
همان طوری که در شکل بالا مشاهده می کنید زمانیکه یک لیگاند گیرنده مربوط به خود را تحریک می کند و به آن متصل می شود این تحریک باعث به کار گیری پروتئین های آداپتور می گردد. در نتیجه پروتئین آداپتور FADDاز ناحیه Cترمینال خود به گیرنده مرگ متصل می شود،همچنین این پروتئین از ناحیه Nترمینال خود که دارای ناحیه موثر مرگ است به ناحیه مشابه درپرودمین پروکاسپاز 8یا10 متصل می شود و تشکیل کمپلکس علامت دهنده القا مرگ(DISC)را می دهد.بدین ترتیب پروکاسپازها فعال شده وبه ترتیب کاسپاز های اجرائی را فعال می کنندو آپوپتوزیس رخ می دهد.
مسیر داخلی Intrinsic pathway
در این مسیر سیتوکروم Cاز فضای بین دو غشای میتوکندری به داخل سلول رها می شود.در حالت عادی Apf1به صورت بی اثر و غیرفعال استدر حضور سیتوکروم تشکیل کمپلکس cفعال می شود.در ناحیه انتهای آمینی دارای دمین CARDو در انتهای کربوکسیلی دارای موتیف WD-40است که حذف می شود.سیتوکرومCو تبادل فسفر بین ATP/ADP باعث الیگومر شدن Apf-1شده و آپوپتوزوم تشکیل می شود.توالی CARDپروکاسپاز 9 به ناحیه CARDدرApf-1 متصل شده کاسپاز 9را فعال می کندکه این کاسپاز به نوبه خود کاسپازهای اجرایی را فعال می کندو آپوپتوزیس رخ می دهد.
میتو کندری و ژن های تنظیم کننده در فرایند آپوپتوزیس
مرگ برنامه ریزی شده توسط ژن های خانواده Bcl-2تنظیم میشوداین کار را توسط کنترل رها سازی سیتوکروم C انجام می دهند.
پروتئین های خانواده Bcl-2به دو دسته تقسیم می شوند:
1-پروآپوپتوتیک
BH123Protein(Bax.Bak)
BH3Only Protein(Bad.Bim.Bid)
-2آنتی آپوپتوتیک
Bcl-2
Bcl-xl
خانواده Bcl-2وچگونگی آزاد سازی سیتوکروم C
اعضای این خانواده در تنظیم فعال سازی پروکاسپاز ها کمک می کنندالبته بعضی از این اجزا مثل Bcl-2و Bcl-xlبا ممانعت از رها سازی سیتوکروم cاز میتوکندری آپوپتوزیس را مهار می کنند.
- 1بعد از فعال شدن کاسپاز (8)این پروتئاز Bidرا شکسته و tBid ایجاد می کند که به طرف غشای میتوکندری رفته و به پروتئین Baxمیتوکندری متصل می شودو باعث آزاد سازی سیتوکروم cمی شود البته tBidمی تواند به Bcl-xlمتصل شود.
2- در روش دیگر Bid شکسته نمی شود در مسیر مستقل از کاسپاز از سیتوزول به میتوکندری می رودو به Bax متصل می شودو یک هترودایمر ایجاد می کند و سیتوکروم cآزاد می شود.
3-همچنین Badاز پروتئین های پرو اپوپتوتیک است که طی آپوپتوزیس از سیتوپلاسم به میتوکندری منتقل می شود در سلول هایی که فاکتور رشد ندارندو نیزدر صورت بالا بودن غلظت کلسیم در سیتوپلاسم یک فسفاتاز فعال شده با کلسیم به نام کلسی تونین ،Badرا دفسفریله می کندو باعث انتقال Bad به میتوکندری می شودBad با Bcl-xlهترودایمر تشکیل می دهد و باعث پیشرفت آپوپتوزیس می شودو فعالیت Bcl-2وBcl-xl را خنثی می کند.
4-آپوپتوزیس مونومر های Baxرا از سیتوزول به غشای میتوکندریای منتقل می کند در آنجا همودایمر تشکیل می دهند و باعث رها سازی سیتوکروم cمیشود.
از دیگر خانواده مهم تنظیم کننده داخل سلولی آپوپتوزیس،IAP ها هستند که آپوپتوزیس را مهار می کنند:
به بعضی از پروکاسپاز ها متصل می شوند واز فعال شدن آنها جلوگیری می کنند همچنین با اتصال به کاسپاز هااز فعالیت آنها جلوگیری به عمل می آورند.چون دارای یک یا چند دمین متصل شونده به عنصر روی هستندبه طور مستقیم به کاسپاز متصل می شوند.و فعالیت پروتئازی آنها را مهار می کنند.
برای ممانعت از عملکردIAP ها زمانیکه میتوکندری سیتوکروم Cرا برای فعالیت Apaf-1رها میکند پروتئین دیگری را رها می کند تا مانع از اتصال IAP ها شود تا فعال سازی مرگ افزایش یابد.