
تازه های بیوتکنولوژی
جدیدترین دستاوردهای بیوتکنولوژی، نانوبیوتکنولوژی و بیوانفورماتیک
تازه های بیوتکنولوژی
جدیدترین دستاوردهای بیوتکنولوژی، نانوبیوتکنولوژی و بیوانفورماتیکوسترن بلاتینگ
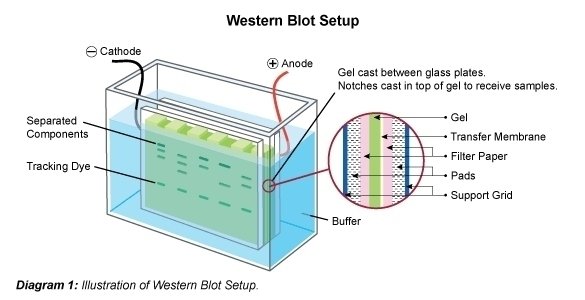
وسترن بلاتینگ یا ایمونوبلاتینگ روشی دو مرحله ای است که طی آن ابتدا باندهای پروتئینی جدا شده بوسیله الکتروفورز از روی ژل SDS-PAGE به غشای دیگری که غالبا از جنس نیتروسلولز می باشد انتقال می یابند و در مرحله دوم توسط آنتی بادی اختصاصی، پروتئین مورد نظر شناسایی می شود. کلمه بلاتینگ به روش انتقال اشاره دارد و کلمه ایمونو به خاطر لزوم استفاده از واکنش بین آنتی ژن و آنتی بادی اختصاصی در مرحله شناسایی می باشد
برای DNA و RNA و لیپیدها نیز روش انتقال مشابهی بکار
برده می شود که به ترتیب southern
blot و northern blot و eastern blot نامیده
می شود.
نیرویی که موجب انتقال مولکول پروتئین
از ژل به غشاء می شود غالبا جریان الکتریکی است اما از نیروی انتشار diffusion و از فشار مکانیکی positive
pressure و از نیروی افینیتی بین آنتی ژن و
آنتی بادی نیز استفاده شده است. انتقال به وسیله جریان الکتریکی را الکتروبلاتینگ
نیز می نامند.
در روش دیفوزیون ساده، غشاء و ژل را
رو در رو به هم می چسبانند پروتئین با انتشار ساده به غشای نیتروسلولز می رسد و به
خاطر خصوصیت این غشا به آن متصل شده و متوقف می شود و کم کم همه پروتئین موجود در
ژل به غشا منتقل می شود این روش زمان زیادی لازم دارد.
در استفاده از فشار مثبت، غشا و ژل در
حد فاصل دو محفظه قرار می گیرند که از بافر بلاتینگ پر می شوند و معمولا به محفظه
بالایی (واقع در پشت ژل) فشار ضعیف و مثبتی اعمال می شود جریان بافر در اثر این
فشار از جانب ژل به طرف غشا برقرار می شود و پروتئین را با خود به غشا می رساند و
در آنجا پروتئین به غشا متصل شده و متوقف می شود
در استفاده از افینیتی (FAT= filter
affinity transfer) معمولاً آنتی
بادی اختصاصی روی غشا وصل می شود (برای جلوگیری از انتشار آن) و ژل در تماس با غشا
قرار می گیرد به مرور آنتی ژن موجود در ژل در اثر افینیتی آنتی بادی به غشا منتقل
می شود.
علاوه بر وسترن بلاتینگ، یک روش سریع
دیگری نیز برای پی بردن به وجود یک پروتئین در نمونه وجود دارد که Dot blotting گفته می شود اما در آن عملا روش انتقال
بصورت نمونه گذاری دستی صورت می گیرد یعنی نمونه (معمولا محلول) را به صورت لکه
دایره ای شکل کوچکی روی غشا می گذارند و سریعا خشک می کنند و در صورت لزوم با
فیکساتور مناسب تثبیت میکنند. از پروتئین های خاص برای مسدود کردن نقاط اتصال
باقیمانده استفاده میکنند. سپس طی مرحله شناسایی پروتئین مورد نظر شناسایی می شود.
مرحله اول: انتقال پروتئین از ژل به
غشاء نیتروسلولز:
طی روند الکتروبلاتینگ (انتقال بوسیله
جریان برق) پروتئین های جدا شده در ژل پلی آکریلامید به کمک نیروی الکتریکی به
غشای دیگری از جنس نیتروسلولز و یا PVDF
و ... منتقل می شوند. برای این کار از
دستگاه الکتروبلاتینگ استفاده می شود
دستگاه الکتروبلاتینگ :
این دستگاه محفظه ای شیشه ای به شکل
زیر است که جایگاه ویژه ای برای فروبردن یک کاست مخصوص در آن قرار دارد (در سطح
داخلی دیواره شیشه ای در دو طرف مقابل هم، دو زایده از جنس شیشه، ناودان خاصی را
ایجاد می کنند که کاست در درون آن قرار گرفته و ثابت می شود) در دو طرف
این جایگاه دو الکترود تعبیه شده اند جنس آند از پلاتین و فیش آن به رنگ قرمز است
جنس کاتد از استیل و فیش آن سیاه رنگ می باشد جنس کاست از شیشه بوده و دارای سوراخ
های درشت در قسمت های جانبی است تا جریان الکتریکی براحتی از آن عبور کند. کاست به
کمک اسفنج ها، محفظه تنگ و فشرده ای را بوجود می آورد که از دو طرف فشار آورده و سطح
رو در روی ژل با غشا را به هم نزدیکتر می کند. کاست منطقه لولا مانندی دارد که
بواسطه آن به طرفین باز می شود. در سطح داخلی آن ابتدا دو لایه ضخیم اسفنج در
طرفین قرار داده می شود بین این دو اسفنج از طرف کاتد (دقت شود) به ترتیب کاغذ
صافی (سه برگ) و ژل و غشای نیتروسلولزی و کاغذ صافی (سه برگ) قرار داده می شود.
غشا و کاغذ صافی ها قبلا با بافر بلاتینگ کاملا خیس می شوند (حدود 15 دقیقه). وقتی
غشای نیتروسلولز و ژل و اسفنج و کاغذ صافی ها به طور صحیح !! در محل خود قرار داده
شدند و کاست در جهتی صحیح !! در ناودان خاص خود در داخل دستگاه فرو برده شد نوبت به اتصال
سیم های رابط می رسد. دو الکترود دستگاه به دو جا فیش قرمز و سیاه متصل هستند که
در بالای دستگاه در معرض دید قرار دارد. دو فیش موجود در دو انتهای سیم رابط قرمز
رنگ به جا فیش های قرمز رنگ موجود در دستگاه بلاتینگ و منبع تغذیه وصل می شوند. دو
فیش مشکی در دو انتهای سیم رابط مشکی نیز به دو جافیش مشکی رنگ موجود در دستگاه
بلاتینگ و منبع تغذیه وصل می شود. وقتی از صحیح بودن جهت قرار گیری ژل به غشا (ژل
به طرف کاتد و غشا به طرف آند) و صحیح بودن اتصال سیم های رابط مطمئن شدید وقت آن
رسیده است که منبع تغذیه روشن شود.
روش کار با منبع تغذیه: منبع تغذیه
طوری ساخته می شود که می تواند یکی از فاکتورها (ولت یا آمپر) را ثابت نگه دارد.
قبل از وصل کردن منبع تغذیه به برق شهری و قبل از روشن کردن کلید آن (اگر کلیدهای
تنظیم کننده ولت و آمپر از آزمایش قبلی در آخرین درجه باز مانده باشند امکان سوختن
فیوز دستگاه به دلیل عبور جریان زیاد وجود دارد) هر دو کلید ولتاژ و شدت جریان را
کاملا می بندیم سپس دستگاه را به برق 220 ولت شهری وصل کرده و کلید دستگاه را از حالت off به حالت on در می آوریم. سپس اگر می خواهیم شدت جریان (آمپر) توسط دستگاه
ثابت نگه داشته شود ابتدا کلید مربوط به ولتاژ را تا آخرین حد باز می کنیم و در
مرحله بعد کلید مربوط به شدت جریان را به آرامی باز می کنیم تا شدت جریان مورد
نیاز تامین شود (به صفحه نمایش بالای این کلید که تغییرات شدت جریان را نشان می
دهد توجه کنید و شدت جریان را آرام آرام بالا ببرید). اما اگر بخواهیم ولتاژ ثابت
بماند بصورت معکوس عمل می کنیم یعنی اول کلید آمپر را تا آخر باز می کنیم سپس کلید
ولتاژ را به اندازه مورد نیاز باز می کنیم.
نکته: برای بالا بردن عمر دستگاه، پس
از اتمام کار، حتما هر دو کلید را در پایین ترین مقدار خود قرار دهید و سپس آن را
خاموش کنید.
نکته: پس از شروع الکتروبلاتینگ، بافر در اثر عبور جریان الکتریکی
گرم می شود در اثر آن مقاومت الکتریکی کاهش یافته و باعث افزایش شدت جریان و ولتاژ
می شود ولی دستگاه یکی از آنها را با تغییر دادن دیگری اصلاح کرده و ثابت نگه می
دارد.
پس از مدت زمان معین (بسته به نوع
آزمایش) وقتی کار الکتروبلاتینگ نمام شد دستگاه خاموش شده و کاست خارج می شود سپس
با احتیاط کامل غشا از بقیه جدا می شود و در یک ظرف تمیز و هم اندازه و به پشت !!
قرار می گیرد تا مراحل بعدی انجام گیرد (برای جلوگیری از اشتباهات بعدی روی غشاء
در یک گوشه با مداد نرم علامت گذاری می شود).
انتخاب ظرف: ظرف بکار برده شده در این
مرحله نباید از ابعاد غشاء خیلی بزرگتر باشد چون باعث مصرف زیاد معرف ها می گردد.
ظرف باید کاملا تمیز و عاری از هر گونه پروتئین باشد چون غشا در این مرحله میتواند
به آسانی پروتئین های موجود در محیط را به خود جذب کند. همچنین کف ظرف باید کاملا
صاف باشد در غیر این صورت حرکت مداوم غشاء در داخل آن (به منظور مخلوط کردن) موجب
آسیب به غشا می گردد.
شستشوی اولیه: برای حذف SDS و ذرات ریز ژل، غشاء چندین بار با
بافر شستشو شسته می شود. موقع شستشو از ریختن مستقیم محلول روی غشا جدا پرهیز کنید
(محلول شستشو و معرف ها را به آرامی و بر روی کف یا دیواره ظرف بریزید) چون باندهای
پروتئنی موجود در روی غشا سست هستند و در اثر کوچکترین فشار مکانیکی دچار پراکندگی
شده و حتی ممکن است کنده شده و موقع شستشو از دسترس خارج شوند.
مرحله بلوکینگ: برای پر کردن محل های
اتصال خالی مانده (نواحی که پروتئین برای اتصال موجود نبوده) از محلول های
پروتئینی مخصوصی استفاده می شود. این کار مانع اتصال ناخواسته آنتی بادی ها به غشاء
در مرحله بعدی می شود. محلول بلوکان به ظرف حاوی غشاء اضافه شده و چند ساعت (حداقل
یک ساعت و با مخلوط کردن آرام) در دمای اتاق و یا تا فردا صبح در 4 درجه (یخچال و
بدون مخلوط کردن) نگهداری می شود. از نگهداری بیش از حد غشاء در این وضعیت پرهیز
کنید چون با این کار در مرحله شناسایی با رنگ زمینه بالایی روبرو خواهید شد.
انتخاب غشاء:
غشاها از نظر بار الکتریکی عوامل
موجود در سطح آنها به سه دسته هستند.
1 - غشای با شارژ مثبت دارای گروه آمونیوم می باشد و برای پروتئین
های با بار منفی و اسیدهای نوکلئیک مناسب است.
2 - غشای با شارژ خنثی دارای بارهای مثبت
(گروه آمین) و منفی (گروه کربوکسیل) مساوی می باشد.
3 - غشای بدون شارژ و هیدروفوب که باز هم
برای پروتئین ها به کار می رود.
تقسیم بندی بعدی غشاها بر اساس اندازه
سوراخ های موجود در آنها است. سوراخ های غشاها: از 0.2 تا 1.2 میکرومتر فرق میکند
0.2 برای بلوت کردن پروتئین یا DNA یا RNA به کار میرود و 1.2 میکرومتر برای موارد خاص مثل plaque and
colony lifts به کار میرود برای بلوت کردن مولکول
های کوچکتر (20000 >) از
غشاهای با منفذ 1 میکرومتر به خوبی استفاده شده است با افزایش اندازه منفذ احتمال
عبور مولکول های کوچکتر از عرض غشا بالا میرود.
غشاهای جدیدی ارائه شده اند که
افینیتی بسیار بیشتر و نقاط اتصال متراکمتری نسبت به پروتئین ها دارند ولی همین
افینیتی بالا موجب ایجاد رنگ زمینه (background) بسیار بالا در هنگام کار با آنها مشاهده میشود که محبوبیت آنها
را کم کرده است.
رنگ روشن کننده محل باندها در روی
نیتروسلولز پانسواس میباشد و میتوان پس از اطمینان از محل باندها آن را با آب مقطر
چندین بار شسته و مراحل بلاتینگ را ادامه داد.
نیتروسلولز نبایـد با کوماسی بلو رنگ
شود در این مورد از رنگ آمیدوبلاک استفاده میشود (Amido black) رنگ های بسیار حساستر از آمیدوبلاک در بازار ارائه شده اند مثل Aurodye .
مزایای بلاتینگ: پروتئین موجود در ژل
در عمق وسطح است ومولکولهای عمقی از دسترس سریع معرف ها دور هستند اما در غشاء در
سطح قرار میگیرند و بیشتر در دسترس هستند در ژل SDS مخصوصا با ژل گرادیانت منافذ خیلی کوچک هستند و مولکول های معرف
به آسانی به مولکول های پروتئین دسترسی ندارند لذا زمان رنگ آمیزی و رنگبری خیلی
طولانی میشود پروتئین ها باید روی ژل SDS فیکس شوند (فیکساتورها ساختمان مولکول پروتئین را تغییر میدهند) در حالیکه
در روی غشا نیازی به فیکس کردن نیست چون غشا به مولکول پروتئین گرایش زیادی دارد و
مانع از پخش خودبخودی آن میشود با اینحال در بهترین شرایط فقط 90 درصد پروتئین
موجود در باند روی SDS به غشا منتقل
میشود و در مراحل شستشو نیز مقادیری از پروتئین که افینیتی پایینی به غشا دارد در
اثر استفاده از دترژانت ها کنده شده و خارج میشود.
غشا مقاوم است وبه راحتی حمل میشود
نگهداری دراز مدت آن نیز میسر است.
نکته : گوشه ژل SDS را برای پی بردن به راست و چپ ژل اندکی میکنیم.
زمان ترانسفر:
ترانسفر از روی ژل ایزوالکتریک فوکوس
مشکل است چون در ژل ایزوالکتریک فوکوسینگ پروتئین ها در محل توقف خود دارای بار
الکتریکی خنثی هستند لذا باید مدت زمان بیشتری ترانسفر ادامه یابد تا منجر به
انتقال پروتئین ها شود.
زمان برای ترانسفر به غلظت ژل آکریلامید
و ضخامت ژل و سیستم بافری و انداره و شکل پروتئین دارد اگر زمان زیادتر و یا
مولکول کوچکتر باشد ممکن است پروتئین از غشای نیتروسلولز نیز رد شود غیر قابل
دسترس گردد و نیز زمان ناکافی موجب ماندن بخشی از پروتئین در روی ژل خواهد شد.
دمای ترانسفر:
دمای بافر در لحظه شروع الکتروبلات
باید 8 درجه باشد و باید بین 8 تا 15 درجه حفظ شود اگر مقدار بافر کم باشد این
مسئله اهمیت بیشتری پیدا میکند دستگاه هایی ارائه شده که مرتبا بافر را در مجرای
بسته ای از داخل یخ عبور میدهند تا گرمای حاصل از عبور جریان خنثی شود.
اثر شدت جریان:
دمای زیاد بافر ناشی از شدت جریان
زیاد موجب میشود بلات ها blurred و یا distored شود جریان های ضعیف نیز بلات های خوبی نمیدهد.
بلوک کردن ( BSA , Non fat Milk و ... )
ضرورت استفاده از محلول بلوک کننده در
واکنشهای رنگ آمیزی با ایمونوگلوبولین :
آنتی بادی یک مولکول باردار است و به
محل های با بار مخالف میتواند متصل شود آنتی بادی با آنتی ژن های دیگر میتواند به
صورت کراس راکت متصل شود مخصوصا اگر آنتی بادی پلی کلونال باشد احتمال این نوع
اتصال بالا میرود.
وجود آنزیم های مشابه با آنزیم به کار
برده شده در سیستم رنگ آمیزی در بین پروتئین های الکتروفورز شده مثلا آنزیم
پراکسیداز یا الکالن فسفاتاز موجود در نمونه که موجب مثبت شدن رنگ آمیزی به طور
کاذب میشود البته این مشکل در رنگ آمیزی بافت ها با ایمونوگلوبولین بیشتر مطرح است
و محلول های خنثی کننده خاصی برای مقابله با آن ابداع شده است و فقط جهت اطلاع در
اینجا بیان میشود.
محلول بلوکان رقت های بالای gelatin, BSA,
ovalbumin میباشد.
سپس پروتئین مورد نظر از بین پروتئین
های دیگر توسط آنتی بادی اختصاصی (مثلا موجود در سرم یک انسان) شناسایی شده و به
آن وصل می شود در مرحله بعد آنتی بادی دومی که در حیوان دیگری برعلیه
ایمونوگلوبولین انسانی تولید شده و با ماده نشاندار کننده ای کونژوگه شده به سطح
غشا اضافه می شود ماده نشاندار معمولاً یک آنزیم (الکالن فسفاتاز یا پراکسیداز) می
باشد سپس سوبسترای اختصاصی آنزیم اضافه می شود در صورت وجود پروتئین مورد نظر در
نمونه مورد آزمایش آنتی بادی موجود در سرم فرد به آن وصل شده و آنتی بادی دوم
(کونژوگه با آنزیم) نیز به آنتی بادی اول وصل می شود پس از شستشو و حذف آنزیم های متصل
نشده سوبسترا به غشا اضافه می شود سوبسترا در اثر آنزیم متصل شده به پروتئین،
تغییر یافته و محصول رنگی تولید می کند محصول سوبسترا باید غیر محلول بوده و در
سطح غشا رسوب کند تا در اثر شستشو حذف نشود. برای بالا بردن حساسیت ردیابی پروتئین
گاها از سوبستراهایی استفاده می شود که خاصیت کمی لومینسسانس دارند برای ثبت و
ظهور آنها از فیلم های حساس رادیولوژی استفاده می شود و سپس توسط دانسیتومتر شدت
نور قرائت می گردد
مرحله رنگ آمیزی:
منوکلونال Antibody
نشاندار کردن آنتی بادی اول با رادیو
اکتیو یا آنزیم ممکن است اما برای هر تستی و هر آنتی بادی باید آنتی بادی را خالص
کرد و نشاندار نمود که مشکل است لذا در عمل آنتی گلوبولین نشاندار به کار برده
میشود این آنتی گلوبولین میتواند منوکلونال و یا پلی کلونال باشد.
برای پایین آوردن background از آنتی بادی منوکلونال به جای Ab پلی کلونال استفاده میشود و رقیق کردن
محلول آنتی بادی مصرفی نیز راه دیگری برای این منظور است.
مقدار و غلظت آنتی بادی برای بلات به
منشا آنتی بادی و اویدیتی آن و غلظت Ag بستگی دارد
برای سنجش واکنش Ab های مختلف با نمونه پروتئینی واحد میتوان نمونه را در همه Trackها ریخت الکتروفورز کرد و بعد از
ترانسفر ، غشا را به صورت نواری برید و با آنتی بادیهای مختلف مجاور نمود.
نکته : پراکسیداز با آزاید غیر فعال
میشود لذا بافر شستشو و محلول آنتی بادی دوم نباید آزاید داشته باشد.
Anti-IgG کونژوگه با HRP یا AP
میتوان با برخی مواد تا اندازه ای
آنزیم های مداخله کننده را غیر فعال کرد آنزیم پراکسیداز در موقع فریز کردن و فیکس
کردن نیز خاصیت خود را حفظ میکند
برای تشخیص آنزیم های مداخله کننده در
واکنش روشنگر میتوان سوبسترا را با حذف مرحله آنتی بادی کونژوگه با آنزیم به کار
برد در این صورت مثبت شدن رنگ آمیزی به آنزیم موجود در نمونه برمیگردد و کاذب است.
محصول سوبسترا باید رنگی و نامحلول
باشد.
سیستم های کونژوگه:
در موقع به کار بردن سیستم کونژوگه
بیوتین-آویـــدیــن یا بـیـــوتین-استرپتاویدین باید توجه نمود که خود نمونه دارای
بیوتین نباشد یعنی باید از آن اطمینان پیدا کرد
اتصال بین بیوتین و استزپتاویدین 10 برابر
محکمتر از اتصال Ag با Ab اختصاصی است
مزیت های استرپتاویدین : اولا دارای
کربوهیدرات در مولکول خود نیست و لذا به مولکول های لکتینی موجود در نمونه نمی
چسبد
نقطه ایزوالکتریک آن نزدیک به خنثی
است و در Ph فیزیولوژیک
اتصال غیر اختصاصی کمتری دارد ولی Ph ایزوالکتریک آویدین 10 است و در Ph فیزیولوژیک دارای بار مثبت است و لذا احتمال اتصال غیر اختصاصی
در آن بالاتر است.
کونژوگه استرپتاویدین با آنزیم
پایداری بیشتری دارد و میتوان محلول رقیق شده و آماده مصرف آن را تا مدت های مدید
نگهداری کرد
لکتین ها میتوانند به جای آنتی بادی
به کار روند در این صورت یا خود لکتین نشاندار است ویا لیگاند آن را نشاندار
میکنیم.
در ECL سوبسترایی
که با Ab دوم حاوی
پراکسیداز واکنش میدهد دارای ماده لومینسسانس است که نور از خود ساطع میکند و این
نور با فیلم های حساس به نور ثبت و بعد قرائت میشود معایب: در مقایسه با
رادیواکتیو زمان ساطع شدن نور محدود است و نمیتوان مثل قبلی برای واکنش Ab های مختلف بر علیه یک پروتئین واحد
بکار برد و حساسیت ECL مساوی یا بیشتر
از رادیولیبل است.


























